Composés de l'ion argent
Le cation Ag + est membre du premier groupe de cations dans le schéma d'analyse qualitative.
Recherche sur Google Images :
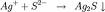
Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Un ion argent à la surface d'une particule de chlorure d'argent a une... Ce composé forme généralement un colloïde quoique sa solubilité ne soit pas... (source : books.google)
Le cation Ag+ est membre du premier groupe de cations dans le schéma d'analyse qualitative.
- Sa réaction la plus caractéristique est la suivante :
cation Ag+ + anion Cl- → précipité de chlorure d'argent (solution un peu nitrique)
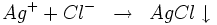
Le chlorure d'argent est soluble dans l'ammoniac et il se forme alors le chlorure de diamine-argent (I) :
![AgCl+2NH_{4}OH\;\;\to\;\; {[}Ag(NH_{3})_{2}{]}Cl+2H_{2}O](illustrations/7863fab67f676c0c2098224f27d891ae.png)
Par chauffage, il y a une décomposition produisant du chlorure d'ammonium et de l'amidure d'argent :
![{[}Ag(NH_{3})_{2}{]}Cl\;\;\to\;\; NH_{4}Cl+AgNH_{2}](illustrations/93767aced754f38274fb8c95b629c57d.png)
L'amidure d'argent est aussi instable et se décompose par la réaction suivante donnant du nitrure d'argent :
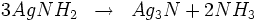
Le nitrure d'argent est explosif et se décompose au choc :
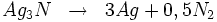
Cette formation de complexe existe aussi avec les anions cyanure et thiosulfate (hyposulfite) pour donner l'ion dicyanoargentate : [Ag (CN) 2]- et l'ion thiosulfato-argentate : [Ag (S2O3) 2]3-
- Les bromures donnent avec le cation Ag+ un précipité jaune pâle de bromure d'argent : AgBr selon la réaction :
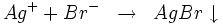
Ce composé est particulièrement peu soluble dans l'ammoniac
- Les iodures donnent avec le cation Ag+ un précipité jaune l'iodure d'argent : AgI insoluble dans l'ammoniac selon la réaction :
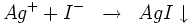
. Ce composé est insoluble dans l'ammoniac.
Dans un excès de nitrate d'argent (AgNO3), AgI se dissous pour former le complexe : AgI. 2AgNO3
- Les sulfures donnent avec le cation Ag+ un précipité noir de sulfure d'argent : Ag2S selon la réaction :
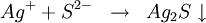
.
- Les bases fortes forment avec l'ion Ag+ un précipité brun d'oxyde d'argent : Ag2O
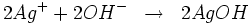
l'hydroxyde d'argent se décompose : :
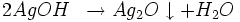
- Le chromate de potassium forme avec l'ion argent du chromate d'argent de couleur rouge brique :
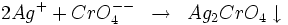
Ce précipité est soluble dans l'acide nitrique et dans l'ammoniac mais insoluble dans l'acide acétique.
- L'acide arsénieux :H3AsO3 donne l'arsénite d'argent précipité de couleur jaune :Ag3AsO3
L'acide arsénique :H3AsO4 donne l'arséniate d'argent de couleur rouge foncé :Ag3AsO4.
Cette différence de couleur sert à distinguer la valence de l'arsenic présent.
- L'hydrogénophosphate de sodium donne avec l'ion Ag +un précipité jaune de phosphate d'argent soluble dans l'acide nitrique et dans l'ammoniac.
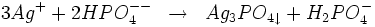
Le cation Ag+ est aisément réduit en Ag métallique par divers réducteurs.
- Réduction par la formaldéhyde
à chaud, nous avons la réaction :
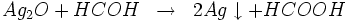
- Réduction par les ions Mn++ selon l'équation :
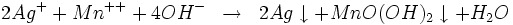
- Action du pyrogallol sur le résidu sec d'une solution de Ag+ donne un précipité d'argent métallique.
Bibliographie
- V. Alexéev - Analyse qualitative - Éditions MIR-Moscou 1970
- (en) C. H. Sorum - Introduction to Semimicro Qualitative Analysis - 3e édition - Prentice-Hall, Inc. 1965
- A. Michel et J. Bénard - Chimie Minérale- 1964- Masson et Cie
- (en) D. F. Shriver, P. W. Atkins, C. H. Langford -Inorganic Chemistry- 1994 - Oxford University Press
- (en) N. A. Lange - Handbook of Chemistry - 10e édition - Mc Graw-Hill Company
- B. Nekrassov - Chimie minérale - Éditions MIR
- (pt) R. B. Heslop e K. Jones - Química inorgânica - Fundação Calouste Gulberman
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité