Éther couronne
Les éthers couronnes sont des composés chimiques hétérocycliques qui, dans leurs formes les plus simples, sont des oligomères cycliques d'oxyde d'éthylène.

Catégories :
Éther - Agent chélatant - Chélation - Chimie analytique - Macrocycle - Chimie supramoléculaire
Recherche sur Google Images :

Source image : chimie.ens.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Chaque type d'éther est spécifique pour un cation... La méthode à "l'ether couronne" est intéressante mais je la soupçonne d'être excessivement ônéreuse.... (source : forums.futura-sciences)
- a) Complexation de cations alcalins et alcalino-terreux... Les éthers couronne sont plus flexibles que les cryptands.... et de décompléxation d'un ion avec un éther couronne est bien plus grand que dans le cas d'un cryptand.... (source : etps.pagesperso-orange)
Les éthers couronnes sont des composés chimiques hétérocycliques qui, dans leurs formes les plus simples, sont des oligomères cycliques d'oxyde d'éthylène. L'unité de répétition principale de tout éther couronne est le groupe éthylènoxy-, soit -CH2CH2O-, qui se répète deux fois dans le dioxane et six fois dans le 18-couronne-6 (ou encore 18-C-6). Le cycle à neuf éléments 1, 4, 7-trioxonane (9-couronne-3) est quelquefois nommé couronne et peut interagir avec les cations. Les macrocycles de type (-CH2CH2O-) n dans lesquels n ≥ 4 sont le plus souvent référés comme éthers couronnes plutôt que sous leurs noms systématiques. Ceci est dû au fait que les structures moléculaires constituées quand les hétérocycles sont liés à des cations ressemblent à une couronne posée sur une tête.
Nomenclature
L'utilisation du terme éther couronne ne correspond pas à la nomenclature IUPAC. Ainsi le 18-couronne-6 (ou 18C6) s'appelle 1, 4, 7, 10, 13, 16-hexaoxacyclooctadécane selon la nomenclature systématique dans laquelle la position de chaque atome d'oxygène est précisée.
Selon la notation de Pedersen, les éthers couronnes sont caractérisés par le nombre total x de chaînons du cycle -atomes de carbone et d'oxygène- et le nombre y d'atomes d'oxygène. Un éther couronne peut alors se symboliser x-couronne-y ou xCy. Implicitement, cette notation indique que la molécule est une répétition d'un motif éthylènoxy-, de sorte à obtenir un total de x atomes dont y d'oxygène.
Utilisation
Les éthers couronnes sont connus pour leur capacité à fortement solvater les cations. En d'autres termes, l'équilibre thermodynamique est fortement en faveur du complexe. Les atomes d'oxygène sont parfaitement positionnés pour se coordonner avec un cation à l'intérieur du cycle, dont l'extérieur est hydrophobe. Le résultat est que le cation complexé est soluble dans des solvants apolaires. La taille de l'intérieur de l'éther couronne détermine la taille du cation qu'il peut solvater. Ainsi, le 18-couronne-6 a une forte affinité pour le cation potassium K+, le 15-couronne-5 pour le cation sodium Na+ et le 12-couronne-4 pour le cation lithium Li+. La forte affinité du 18-couronne-6 pour les ions potassium le rend toxique pour l'homme.
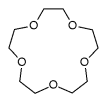
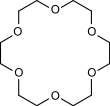
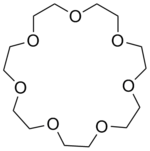
| 12-couronne-4 | 15-couronne-5 | 18-couronne-6 | 21-couronne-7 | |
|---|---|---|---|---|
| Structure | 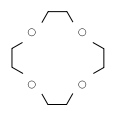 |
 |
 |
 |
| Numéro CAS | ||||
| Formule brute | C8H16O4 [Isomères] 176, 210564 g∙mol-1 |
C10H20O5 220, 263205 g∙mol-1 |
C12H24O6 264, 315846 g∙mol-1 |
C14H28O7 308, 368487 g∙mol-1 |
| Diamètre interne | 0, 12 - 0, 15 nm [1] | 0, 15 - 0, 22 nm [1] | 0, 26 - 0, 32 nm [1] | 0, 34 - 0, 43 nm [1] |
Les éthers couronnes ne sont pas les seuls ligands macrocycliques qui possèdent une affinité pour l'ion potassium. Des ionophores comme la nonactine et la valinomycine démontrent aussi une sélectivité vers cet ion plutôt que vers d'autres.
Origine
Les plus anciens rapports sur les éthers couronnes furent centrés sur les méthodes de synthèse pour leur production ; leurs propriétés et les implications théoriques furent étudiées énormément plus tard.
En 1967, Charles Pedersen, chimiste chez DuPont, découvrit une méthode simple de synthèse d'un éther couronne quand il essayait de préparer un agent de complexation pour cations divalents [2]. Sa stratégie consistait à lier deux catéchols par un groupement hydroxyle sur chaque molécule. Ce procédé lui aurait donné un composé qui devait partiellement envelopper le cation, et , par ionisation des hydroxyles phénoliques, aurait neutralisé la liaison dication. Il fut surpris d'isoler un produit secondaire qui liait ou complexait le cation potassium mais n'avait pas de groupe hydroxyle ionisable. En consultant des travaux qui ont précédé sur la dissolution du potassium dans du 16-couronne-4 [3], [4], il réalisa que les polyéthers cycliques représentaient une nouvelle classe d'agents complexants capables de lier les cations alcalins. Il procéda alors à un rapport d'études systématiques de la synthèse et des propriétés liantes des éthers couronnes dans une série de publications. Les domaines des réactifs de synthèse anionique, des catalyseurs de transfert de phase, du transfert ionique biologique, et d'autres disciplines ont bénéficié en profondeur de la découverte des éthers couronnes.
Pedersen reçut le Prix Nobel de Chimie en 1987 pour la découverte des voies de synthèse et des propriétés liantes des éthers couronnes (conjointement avec Donald Cram et Jean-Marie Lehn pour leurs contributions à la chimie supramoléculaire)
Les aza-couronnes
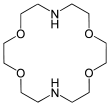
Des analogues azotés des éthers couronnes existent, comme par exemple le cyclène. Il est aussi envisageable de synthétiser des couronnes mixes aza et éther dénommées aza-éther-couronnes. À la différence des éthers-couronnes, les couronnes azotées permettent de complexer les anions par liaison Hydrogène avec le proton acide de l'azote.
| 1, 4, 7, 10-tétraazacyclodoécane | diaza-18-couronne-6 | |
|---|---|---|
| Structure | 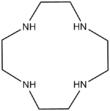 |
 |
| Numéro CAS | ||
| Formule brute | C8H20N4 172, 27168 g∙mol-1 |
C12H26N2O4 262, 346404 g∙mol-1 |
Les thioéther-couronnes
Les éthers couronnes dont l'atome d'oxygène a été remplacé par un atome de soufre sont nommées thioéther-couronne.
| 1, 5, 9, 13-tétrathiacyclohexadécane | |
|---|---|
| Structure | 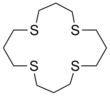 |
| Numéro CAS | |
| Formule brute | C12H24S4 296, 58376 g∙mol-1 |
Références
- (en) Katsuhiko Ariga et Toyoki Kunitake, Supramolecular Chemistry – Fundamentals and Applications Advanced Textbook, Springer-Verlag Berlin Heidelberg, 2003, 1re éd. , 208 p. (ISBN 3-540-01298-2) [lire en ligne], p. 13
- C. J. Pedersen, J. Am. Chem. Soc. , 1967, 89, 7017.
- D. G. Stewart. D. Y. Waddan and E. T. Borrows, British Patent 785, 229, Oct. 23, 1957.
- J. L. Down, J. Lewis, B. Moore and G. W. Wilkinson, Proc. Chem. Soc., 1959, 209; J. Chem. Soc., 1959, 3767.
Voir aussi
Lien externe
- Discours Nobel de Charles Pedersen.
- G. W. GOKEL*, H. D. DURST, Principles and Synthetic Applications in Crown Ether Chemistry, Synthesis, 1976, 168-184
- (en) Cet article est partiellement ou en totalité issu de l'article de Wikipédia en anglais intitulé «crown ether» (voir la liste des auteurs)
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité