Acide tartrique
L‘ acide tartrique est le nom courant de l'acide 2,3-dihydroxybutanedioïque, qui a pour formule brute C 4 H 6 O 6. Sa formule semi-développée est HOOC-CHOH-CHOH-COOH.

Catégories :
Produit chimique corrosif - Acide dicarboxylique - Acide hydroxylé - Vinification - Saveur acide - Régulateur alimentaire de pH - Séquestrant - Agent chélatant - Chélation - Chimie analytique
Recherche sur Google Images :

Source image : mon-droguiste.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Fiche produit. Acide tartrique naturel (E334)... Il existe 4 formes stéréo- isomères d'acide tartrique, mises en évidence par Louis PASTEUR lors de ses... (source : fauresa)
- ... L'acide tartrique est présent dans de nombreuses plantes.... avec de la craie et décomposa le produit en présence d'acide sulfurique.... (source : fr.ekopedia)
- Alimentation, gastronomie du sud ouest , produits alimentaires : Acide tartrique E334 Se présente sous forme de cristaux monocliniques incolores et ... (source : meilleurduchef)
| acide tartrique | |
|---|---|
 |
|
| Général | |
| Nom IUPAC | acide 2, 3-dihydroxybutanedioïque |
| Synonymes | acide 2, 3-dihydroxy succinique |
| No CAS | L (+) ou (2R, 3R) D (−) ou (2S, 3S) meso ou (2R, 3S) (racémique) |
| No EINECS | (L) (D) (DL) |
| PubChem | |
| No E | E334 |
| FEMA | |
| SMILES |
|
| InChI |
|
| Apparence | poudre cristalline blanche[1] |
| Propriétés chimiques | |
| Formule brute | C4H6O6 [Isomères] |
| Masse molaire[2] | 150, 0868 ± 0, 0054 g·mol-1 C 32, 01 %, H 4, 03 %, O 63, 96 %, |
| pKa | 3, 04, 4, 37 |
| Propriétés physiques | |
| T° fusion | 206 °C[1] |
| Solubilité | dans l'eau : 206 g·l-1 à 20 °C[1] |
| Masse volumique | 1, 79 g·cm-3[1] |
| T° d'auto-inflammation | 425 °C[1] |
| Point d'éclair | 210 °C (coupelle ouverte) [1] |
| Thermochimie | |
| Cp |
|
| Précautions | |
|
|
|
|
|
|
Acide tartrique : Acide tartarique (d-) :  Acide méso-tartarique :  Acide tartarique (l-) :  |
|
|
|
|
L‘acide tartrique est le nom courant de l'acide 2, 3-dihydroxybutanedioïque, qui a pour formule brute C4H6O6. Sa formule semi-développée est HOOC-CHOH-CHOH-COOH. L'acide tartrique est présent dans de nombreuses plantes. Il fut isolé pour la première fois en 1769, par le chimiste suédois Carl Wilhelm Scheele, qui fit bouillir du tartre avec de la craie et décomposa le produit en présence d'acide sulfurique. Il peut être synthétisé. C'est le principal acide du vin (provenant du raisin), sous sa forme L (+).
Les ions tartrates sont utilisés dans la liqueur de Fehling pour tester la présence d'aldéhydes. Le tartrate de potassium évite une cristallisation du vin en bouteille, phénomène exploité dès l'antiquité par les grecs et les romains.
Chimie
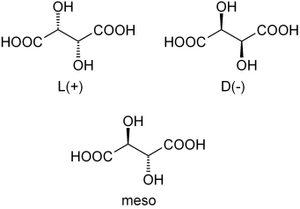
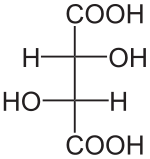
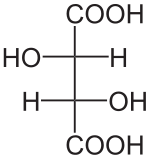
L'acide tartrique possède deux atomes de carbone asymétriques mais ne possède que trois stéréoisomères car le (R, S) -acide tartrique est un composé achiral dit "méso" car possédant deux atomes de carbone asymétriques tout en ayant un centre de symétrie.
Propriétés
L'acide tartrique active la salivation ; il est un peu laxatif et diurétique. Il se présente sous la forme de cristaux transparents incolores solubles dans l'eau. Les sels de l'acide tartrique sont les tartrates qui sont toujours à craindre et sont évités en traitant le vin par le froid, pour éliminer le maximum de tartre, peut-être en ajoutant un inhibiteur de cristallisation (acide métatartrique). On détecte l'acide tartrique par le résorcinol.
Isomérie
Louis Pasteur a étudié l'activité optique des isomères optiques des tartrates. La fermentation des jus de raisin produit sur la surface interne du récipient une croûte blanche de tartrate acide de potassium ou tartre brut. Le tartre brut, bouilli en présence d'acide chlorhydrique dilué, précipite sous forme de tartrate de calcium, par addition d'hydroxyde de calcium. Son traitement par de l'acide sulfurique dilué libère la forme dextrogyre (+) de l'acide tartrique, composé qui fait tourner le plan de polarisation de la lumière polarisée vers la droite. L'acide L (+) -tartrique a une température de fusion de 170 °C et est aisément soluble dans l'eau et l'alcool. Il est insoluble dans l'éther. Il existe une autre forme de l'acide tartrique, l'acide D (–) -tartrique (levogyre). Elle a la même structure que la forme L (+), mais fait tourner le plan de polarisation de la lumière vers la gauche. Cet acide fut préparé pour la première fois vers 1847 par Louis Pasteur dans le cadre de son doctorat, à partir du sel d'ammonium et de sodium. L'acide tartrique préparé en laboratoire est un mélange équimolaire des formes dextrogyre (+) et lévogyre (–). Ce mélange, dit racémique, du nom ancien de ce produit, l'acide racémique, ne modifie pas la direction du plan de polarisation de la lumière. Il existe une troisième variété, l'acide mésotartrique, qui, chirale, ne modifie pas non plus la direction du plan de polarisation de la lumière.
Utilisations
Il est utilisé comme acide solide dans les cachets contre les indigestions et les maux de tête.
Quand on les met dans l'eau, l'acide se dissout et réagit avec le bicarbonate de sodium pour libérer du dioxyde de carbone gazeux.
Il est utilisé dans l'alimentation comme additif alimentaire (numéro E334[8]), essentiellement comme antioxydant, régulateur de pH et séquestrant[9]. Il est autorisé dans la majorité des produits alimentaires et dans certains produits spécifiques tels que les produits de cacao et de chocolat, les confitures et gelées, les fruits et légumes en conserve, les pâtes fraîches et les biscuits et biscottes destinés aux nourissons[8].
Il possède aussi une autre utilisation assez courante : occasionnellement précis, il permet, par ses propriétés de recristallisation (acide tartrique L- (+) et D- (–) ), de séparer deux énantiomères.
En gravimétrie, on utilise une solution d'acide tartrique pour précipiter le calcium, le potassium, le magnésium, la scandium, le strontium et le tantale[10].
Notes et références
- ACIDE TARTARIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Gulf Pub. Co., Huston, Texas (ISBN 0-88415-857-8)
- «Acide tartrique» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- «Acide tartarique (d-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- «Acide méso-tartarique» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- «Acide tartarique (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Commission européenne, «La directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants», dans Journal officiel, no L 61, 18/03/1995, p. 1-56. [lire en ligne] [pdf]
- Codex Alimentarius, Noms de catégorie et dispositif international de numérotation des additifs alimentaires. CAC/GL 36-1989, p1-35. [lire en ligne] [pdf]
- (en) John Aurie Dean, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 1998, 15e éd. , 1424 p. (ISBN 0070163847) , p. 11.67
Liens et documents externes
- (en) DL-TARTARIC ACID Compendium of Food Additive Specifications (Addendum 7) - Joint FAO/WHO Expert Committee on Food Additives 53rd session - Rome, 1-10 June 1999
Voir aussi
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité