Électrophorèse des protéines
En protéomique et en médecine, l'électrophorèse des protéines est une méthode d'analyse d'un mélange de protéines par une électrophorèse sur gel, essentiellement dans le sérum sanguin.
|
Recherche sur Google Images :
Source image : fr.academic.ru Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Le principe de l'électrophorèse des protéines est connu depuis les premiers travaux de Tiselius dans les ... migration est inversé comparé à l'électrophorèse sur gel.... ces est due au fait que ces molécules absorbent à la lon-... (source : cnbh)
- Le principe de l'électrophorèse des protéines est connu depuis les premiers travaux... L'ordre de migration est inversé comparé à l'électrophorèse sur gel car le .... La raison de ces interférences est due au fait que ces molécules... (source : john-libbey-eurotext)
En protéomique et en médecine, l'électrophorèse des protéines est une méthode d'analyse d'un mélange de protéines par une électrophorèse sur gel, essentiellement dans le sérum sanguin (le plasma sanguin ne convient pas).
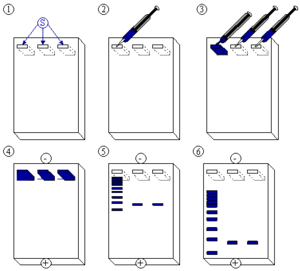
L'électrophorèse est une technique chimique d'analyse des masses des molécules. Elle repose sur la capacité des boutons chargées à migrer au travers des pores d'un gel quand on applique un courant électrique. Si on maîtrise la porosité fine du gel, les molécules vont migrer vers le pôle électrique opposé de leur charge selon leur taille.
Les protéines sont des molécules amphiphiles (qui portent des charges positives et négatives situées sur les chaînes latérales des acides aminés). Elles adoptent des structures tridimensionnelles caractéristiques et certaines charges peuvent être exposées à la surface de la molécule, comme elle peuvent être enfouies au cœur de la molécule. L'analyse comparative des masses moléculaires va par conséquent s'effectuer sur des protéines dénaturées de leurs structures tertiaires et secondaires. Un détergent de type anionique recouvre les chaînes de polymère dénaturé en leur conférant une charge (rapport charge/acide-aminé constant). Les différentes protéines d'un mélange complexe se trouvent par conséquent recouvertes d'un "manteau" de charges négatives.
Quand on applique une tension continue entre les extrémités d'un gel où a été déposé le mélange complexe de protéines, les protéines migrent au travers des mailles constituant le gel. Les mailles du gel retiendront moins les petites molécules qui auront alors la migration la plus grande. Les molécules les plus longues seront d'autant plus retenues entre les mailles du gel et auront une migration relative plus faible.
Différents procédés sont utilisés pour révéler la migration des protéines. La plus courante/basique consiste en une coloration spécifique des protéines. Le gel est coloré et il fait apparaître un profil électrophorétique qui met en évidence des bandes dont l'intensité reflète partiellement l'abondance dans le mélange et la position/migration reflète la masse moléculaire relative. Cette masse moléculaire est comparée à des étalons commerciaux calibrés en unité de masse protéique (Dalton, Da - On exprime la masse d'une protéine en Da et kDa essentiellement)
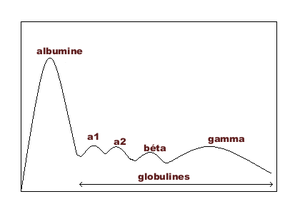
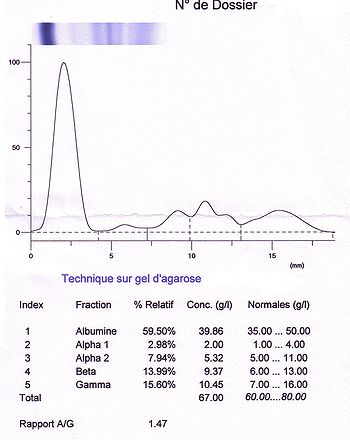
Interprétation
Voir aussi
- Électrophorèse sur gel
- Paraprotéine
- Electrofocusing
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité