Rapport masse sur charge
Le rapport masse sur charge est une quantité physique beaucoup utilisée en électrodynamique des particules chargées, c'est-à-dire en optique électronique et en optique ionique.
|
Recherche sur Google Images :
Source image : versailles-grignon.inra.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- ... Le rapport masse sur charge est directement mesurable à partir du temps de vol. Un analyseur à temps de vol se compose d'une zone... (source : proteine.wikibis)
- Le rapport masse sur charge est directement mesurable à partir du temps de vol. Trajectoire d'un ion dans l'analyseur à temps de vol en mode linéaire... (source : dictionnaire.sensagent)
Le rapport masse sur charge est une quantité physique beaucoup utilisée en électrodynamique des particules chargées, c'est-à-dire en optique électronique et en optique ionique. Elle est utilisée dans les domaines scientifiques de la lithographie, de la microscopie électronique, des tubes à rayons cathodiques, de la physique des accélérateurs (en) de la physique nucléaire de la spectroscopie Auger de la cosmologie et de la spectrométrie de masse[1].
L'importance de cette notion réside dans ce que, selon l'électrodynamique classique, deux particules de même rapport masse sur charge suivent dans le vide une trajectoire semblable quand elles sont soumises aux mêmes champs électriques et magnétiques.
Origine
Quand des particules chargées sont en mouvement dans des champs magnétiques et électriques, les deux lois suivantes s'appliquent :
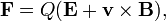 (loi des forces de Lorentz)
(loi des forces de Lorentz)
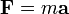 (Deuxième loi du mouvement de Newton)
(Deuxième loi du mouvement de Newton)
où :
- F représente la force appliquée à l'ion,
- m, la masse de la particule,
- a, l'accélération,
- Q, la charge,
- E, le champ électrique,
- et v x B, le produit vectoriel de la vitesse de l'ion et du champ magnétique.
En utilisant la Troisième loi du mouvement de Newton, ces équations deviennent :
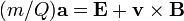 .
.
Cette équation différentielle est l'équation classique de mouvement d'une particule chargée dans le vide. Si on connaît d'autre partles conditions initiales de la particule, cette équation en détermine le mouvement dans l'espace et dans le temps. Il apparaît par conséquent immédiatement que deux particules ayant le même rapport m/Q se comportent de la même façon à partir de conditions initiales semblables. C'est pourquoi ce rapport est une quantité physique importante dans les domaines scientifiques où les particules chargées interagissent avec des champs magnétiques (B) ou électriques (E).
Exceptions
Il existe des effets non-classiques qui dérivent de la mécanique quantique, tels que l'expérience de Stern et Gerlach, qui peuvent faire diverger la trajectoire d'ions ayant un rapport m/Q semblable. Ces effets ne sont pas évoqués ici.
Symboles et unités
Pour désigner la masse, la nomenclature IUPAC recommande d'utiliser le symbole m[2]. Pour une charge, elle recommande Q[3] ; cependant, on rencontre aussi le q particulièrement couramment. La charge est une propriété scalaire, ce qui veut dire qu'elle peut autant être positive (symbole +) que négative (-). Quelquefois, cependant, le signe de la charge est indiquée indirectement. Le Coulomb est l'unité SI de la charge ; cependant d'autres unités sont habituelles.
L'unité SI de la quantité physique m⁄Q est le kilogramme par Coulomb :
[m⁄Q] = kg/C.
En spectrométrie de masse, les système d'unités atomiques sont utilisées normalement :
[m⁄Q] = u⁄e = Da⁄e = Th (le Thomson, unité ad-hoc (en) ).
On utilise fréquemment une notation "sans unité" m/z (en) pour les variables indépendantes d'un spectre de masse. Ces notations sont en relation étroite au travers de l'unité de masse atomique et de la charge élémentaire.
Histoire
Au 19ème siècle, le rapport de masse sur charge de certains ions furent mesurés par des méthodes électrochimiques. En 1897, le rapport de masse sur charge, [m⁄e], de l'électron fut en premier lieu mesuré par J. J. Thomson[4]. Ce faisant, il montra que l'électron, dont on avait antérieurement postulé l'existence pour expliquer l'électricité, était en réalité une particule avec une masse et une charge ; il montra aussi que son ratio de masse sur charge était bien inférieur à celui de l'ion hydrogène H+. En 1898, Wilhelm Wien sépara les ions selon leur ration de masse sur charge avec un appareil optique à ions sur lequel il appliqua des champs magnétiques et électriques (les filtres de Wien (en) ). En 1901, Walter Kaufman (en) mesura l'augmentation de masse relative d'électons rapides. En 1913, Thomson mesura le rapport de masse sur chage d'ions avec un instrument qu'il baptisa un spectrographe parabolique[5]. Aujour'hui, l'instrument pour mesurer le rapport de masse sur charge se nomme un spectromètre de masse.
Rapport de masse sur charge
Le rapport masse sur charge (m/z) d'un objet est , comme son nom l'indique, sa masse divisée par sa charge électrique. Cette quantité n'est le plus souvent utile que pour les objets qui peuvent être traités comme des particules. Pour les objets de plus grandes dimensions, la charge totale, la densité de charge, la masse totale et la densité de masse sont souvent plus utiles.
Signification
Dans certaines expériences, le rapport de masse sur charge est l'unique quantité pouvant être directement mesurée. Il arrive fréquemment que la charge puisse être inférée à partir de considérations théoriques, en sorte que ce rapport apporte un moyen de déduire la masse.
On peut fréquemment déterminer le rapport de masse sur charge à partir de l'observation des déflections d'une particule chargée dans un champ magnétique extérieur. L'équation cyclotron, en combinaison avec d'autres informations telles que l'énergie cinétique de la particule, donne le rapport de masse sur charge. Le spectromètre de masse est une application de ce principe. On peut utiliser le même principe pour extraire les informations dans des expériences qui utilisent les chambres à brouillard.
Le rapport des forces électrostatiques et gravitationnelles entre deux particules est proportionnel au produit de leur rapport de masse sur charge. Il en découle qu'au niveau subatomique, les forces gravitationnelles sont négligeables.
L'électron
| Cet article est en cours de traduction et certains passages délicats sont toujours dans les deux langues. |
|---|
Le quotient de la charge de l'électron par sa masse, − e / me, est une quantité en physique expérimentale. Il a une certaine importance parce qu'il est complexe de mesurer directement la masse de l'électron, me, et , à la place, elle est dérivée de mesures de la charge principale e et e / me. Elle a aussi une signification historique : la mesure de e / me par Thomson l'a convaincu que les rayons cathodiques étaient des particules que nous reconnaissons actuellement pour des électrons.
La valeur recommandée pour − e / me par le Comité de données pour la science et la technologie (CODATA) de 2006 est − e / me = -1.758 820 150 (44) 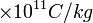 . Le CODATA sert à désigner sous le nom de quotient de charge à masse de l'électron, mais le terme rapport est fréquemment utilisé.
. Le CODATA sert à désigner sous le nom de quotient de charge à masse de l'électron, mais le terme rapport est fréquemment utilisé.
En 1897, J. J. Thomson réussit à calculer le "q/m" d'un électron, et avec toujours plus de réussite, il fit usage de la méthode Dunnington qui mêle le moment angulaire et la déflection génèrée par un champ magnétique perpendiculaire.
En dehors des méthodes de J. J. Thomson et de Dunnington, il existe deux autres méthodes courantes pour mesurer le rapport de masse sur charge d'un électron :
1. La méthode Magnétron : en utilsant une vanne GRD7 (vanne Ferranti (en) ), l'électron d'un filament de tungstène incandescent est expulsé vers une anode. Il est ensuite dévié au moyen d'un solénoïde. Les valeurs du courant dans le solénoïde et dans la vanne de Ferranti permettent le calcul d'e/m.
2. La méthode du tube à rayon fin : l'électron est accéléré depuis une cathode vers une anode en forme de chapeau. L'électron est expulsé tube à rayons rempli d'hélium, ce qui produit un cercle lumineux. Le rayon de ce cercle permet le calcul d'e/m.
L'effet Zeeman
On peut aussi mesurer le rapport de masse sur charge d'un électron avec l'effet Zeeman, qui produit des sauts d'énergie en présence d'un champ magnétique B.
Voir aussi
- Unité de masse atomique
- ISO 31-0 (en) Norme internationale sur les quantités et les unités.
Références
(en) Cet article est partiellement ou en totalité issu de l'article en anglais intitulé «mass-to-charge ratio» (voir la liste des auteurs)
- (en) A. D. McNaught et A. Wilkinson, IUPAC Compendium of Chemical Terminology, 2nd ed. : the "Gold Book", Royal Society of Chemistry, Cambridge, UK (ISBN 0-9678550-9-8) [lire en ligne]
- (en) Collectif, Quantities units and symbol in Physical chemistry, 3rd ed. : the IUPAC "Green Book", ? (Royal Society of Chemistry, Cambridge, UK) (ISBN 13 978 0 85404 433 7) [lire en ligne]
- (en) Collectif, Quantities units and symbol in Physical chemistry, 3rd ed. : the IUPAC "Green Book", ? (Royal Society of Chemistry, Cambridge, UK) (ISBN 13 978 0 85404 433 7) [lire en ligne]
- Philosophical Magazine, 44, 293 (1897). lemoyne. edu
- Proceedings of the Royal Society A 89, 1-20 (1913) [cité in Henry A. Boorse & Lloyd Motz, The World of the Atom, Vol. 1 (New York : Basic Books, 1966) ] lemoyne. edu
Bibliographie
- Szilágyi, Miklós, Electron and ion optics, Plenum Press, New York, 1988 (ISBN 0-306-42717-6)
- Septier, Albert L., Applied charged particle optics, Academic Press, Boston, 1980 (ISBN 0-12-014574-X)
- Vocabulaire international des termes fondamentaux et généraux de métrologie, International Organization for Standardization, 1993 (ISBN 92-67-01075-1) CC.
- IUPAP Red Book SUNAMCO 87-1 "Symbols, Units, Nomenclature and Fundamental Constants in Physics" (pas de version en-ligne).
- Symbols Units and Nomenclature in Physics IUPAP-25 IUPAP-25, E. R. Cohen & P. Giacomo, Physics 146A (1987) 1-68.
Liens externes
- Brochure du BIPM SI
- Manuel de style de l'AIP
- Publications sur les Unités et manuscript check-list du NIST
- Instructions on quantities and units de Physics Today
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité