Ammoniaque
L'ammoniaque, ou hydroxyde d'ammonium, est une solution aqueuse constituée à partir d'ammoniac, qui est un gaz à l'odeur extrêmement irritante.

Catégories :
Produit chimique corrosif - Produit chimique dangereux pour l'environnement - Test chimique - Chimie analytique - Amine - Composé de l'ammonium - Hydroxyde
Définitions :
- Solution aqueuse (NH4OH) constituée à partir d'ammoniac, utilisée surtout comme produit d'entretien à usage domestique (source : fr.wiktionary)
- solution aqueuse du gaz ammoniaque utilisée pour stabiliser le latex. (source : artificina)
| Ammoniaque | |||
|---|---|---|---|
| Général | |||
| Nom IUPAC | solution aqueuse d'hydroxyde d'ammonium |
||
| No CAS | |||
| No EINECS | |||
| No E | E527 | ||
| Apparence | solution particulièrement volatile, incolore, d'ammoniac dans l'eau, d'odeur âcre[1]. | ||
| Propriétés chimiques | |||
| Formule brute | NH4OH | ||
| Masse molaire[2] | 35, 0458 ± 0, 0008 g·mol-1 H 14, 38 %, N 39, 97 %, O 45, 65 %, |
||
| Propriétés physiques | |||
| T° fusion | (25%) -58 °C[1] | ||
| T° ébullition | (25%) 38 °C[1] | ||
| Solubilité | dans l'eau : miscible[1] | ||
| Masse volumique | (eau = 1) : (25%) 0.9[1] | ||
| Pression de vapeur saturante | à 20 °C : (25%) 48 kPa[1] | ||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 34, 50, | |||
| Phrases S : (1/2), 26, 36/37/39, 45, 61, | |||
|
|
|||
|
|||
|
|
|||
 |
|||
|
|
|||
  Danger |
|||
|
|
|||
L'ammoniaque, ou hydroxyde d'ammonium, (NH4OH) est une solution aqueuse constituée à partir d'ammoniac (NH3), qui est un gaz à l'odeur extrêmement irritante.
L'ammoniac en solution réagit avec l'eau selon l'équilibre suivant :
Et l'hydroxyde d'ammonium (NH4OH) constitué se dissocie comme suit :
On voit qu'il y a libération d'ions hydroxyde (HO-), qui confèrent à la solution d'ammoniac son caractère basique (au sens d'Arrhenius). Le pKa (constante de dissociation) du couple NH4+/NH3 est de 9, 2 seulement : l'ammoniaque est une base faible.
Si l'ammoniaque n'est pas un produit dangereux, il est néanmoins particulièrement volatil, le gaz libéré (l'ammoniac) est extrêmement irritant et peut provoquer de vives douleurs. Qui plus est , son mélange avec l'iode peut présenter des caractères explosifs. L'ammoniac est transformé en acide nitrique via le procédé Ostwald.
L'ammoniaque ne peut pas être conservé pendant une longue durée. Il doit être entreposé si envisageable dans des flacons de petite taille, bien fermés, car il réagit avec le dioxyde de carbone (CO2) atmosphérique et donne du carbonate d'ammonium en modifiant le pH de la solution. Ce phénomène abaisse la concentration de la solution en ammoniaque (phénomène commun à l'ensemble des solutions basiques).
In vivo l'ammoniaque est transporté de façon non toxique par un acide aminé, l'acide glutamique, qui subit une condensation et «porte» le groupement NH3+ en donnant un amide : la glutamine. La glutamine transporte l'ammoniaque sans être toxique jusqu'aux reins et/ou au foie où il peut intervenir dans le cycle de l'urée.
Notes et références de l'article
- HYDROXYDE D'AMMONIUM (solution 10% - 35%) , fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- «Hydroxyde d'ammonium» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Voir aussi
Liens et documents externes
- L'ammoniac et ses solutions aqueuses, fiche toxicologique INRS.
Recherche sur Google Images : |

"L'ammonium et l'azote total" L'image ci-contre est extraite du site usinenouvelle.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (467 × 467 - 9 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


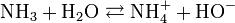
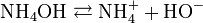
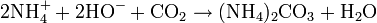

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité