Acide nitrique
L'acide nitrique, quelquefois nommé acide azotique, est un composé chimique liquide particulièrement corrosif de formule chimique HNO 3.

Catégories :
Produit chimique corrosif - Produit chimique comburant - Nitrate - Composé de l'azote - Oxoacide
Recherche sur Google Images :

Source image : mon-droguiste.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- L'acide nitrique est industriellement principal des dérivés oxygénés... Dans le chapitre "Propriétés chimiques " : … à 700-800 0C l'azote passe au... (source : universalis)
- priétes chimiques). En cas d'incendie ou est impliqué l'acide nitrique, les agents d'extinction preoonises... d'acide nitrique est suivie de douleurs buc-... (source : inrs)
- L'acide nitrique est un des composés minéraux principaux pour l'industrie chimique ; la France en produit ainsi plus de 2 millions de tonnes... (source : personnel.univ-reunion)
| Acide nitrique | |||||
|---|---|---|---|---|---|
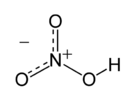 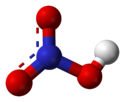 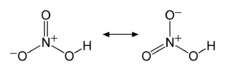  Structure de l'acide nitrique. |
|||||
| Général | |||||
| Nom IUPAC | acide nitrique nitrate d'hydrogène |
||||
| Synonymes | Acide azotique | ||||
| No CAS | |||||
| No EINECS | |||||
| PubChem | |||||
| ChEBI | |||||
| SMILES |
|
||||
| InChI |
|
||||
| Apparence | liquide incolore a jaune, d'odeur acre. (70%) [1], Liquide transparent ou brun |
||||
| Propriétés chimiques | |||||
| Formule brute | HNO3 [Isomères] |
||||
| Masse molaire[3] | 63, 0128 ± 0, 0012 g·mol-1 H 1, 6 %, N 22, 23 %, O 76, 17 %, |
||||
| pKa | -1, 37 | ||||
| Moment dipolaire | 2, 17 ± 0, 02 D [2] | ||||
| Propriétés physiques | |||||
| T° fusion | -41, 6 °C (70%) [1] | ||||
| T° ébullition | 121 °C (70%) [1] | ||||
| Solubilité | dans l'eau : miscible[1] | ||||
| Masse volumique | 1, 4 g·cm-3 (70%) [1] | ||||
| Pression de vapeur saturante | à 20 °C : 6, 4 kPa (70%) [1] | ||||
| Viscosité dynamique | 0, 88 mPa·s à 20 °C | ||||
| Thermochimie | |||||
| S0liquide, 1 bar | 266, 39 J/mol·K | ||||
| ΔfH0liquide | -174 kJ/mol | ||||
| ΔvapH° | 39, 1 kJ·mol-1 (1 atm, 25 °C) [4] | ||||
| Propriétés électroniques | |||||
| 1re énergie d'ionisation | 11, 95 ± 0, 01 eV (gaz) [5] | ||||
| Précautions | |||||
|
|
|||||
|
|||||
|
|
|||||
| Phrases R : 8, 35, | |||||
| Phrases S : (1/2), 23, 26, 36, 45, | |||||
|
|
|||||
|
|||||
|
|
|||||
| fumant :
> 40% : < 40% [6] : |
|||||
|
|
|||||
  |
|||||
|
|
|||||
  Danger |
|||||
| Inhalation | Très dangereux, les vapeurs peuvent être mortelles | ||||
| Peau | Provoque des brûlures graves | ||||
| Yeux | Provoque des brûlures graves | ||||
| Ingestion | Toxique, provoque des brûlures graves pouvant être mortelles |
||||
| Écotoxicologie | |||||
| Seuil de l'odorat | bas : 0, 27 ppm[10] | ||||
|
|
|||||
L'acide nitrique, quelquefois nommé acide azotique, est un composé chimique liquide particulièrement corrosif de formule chimique HNO3. C'est un acide fort, le plus souvent utilisé en solution aqueuse, couramment nommée «eau-forte» par les alchimistes puis les graveurs sur cuivre. Si la concentration est supérieure à 86%, il est baptisé «acide nitrique fumant». L'acide nitrique est aussi un composant des pluies acides.
Histoire
L'acide nitrique a été synthétisé pour la première fois à la fin du VIIIe siècle par l'alchimiste Jabir Ibn Hayyan qui l'obtint en chauffant du salpêtre KNO3 en présence de sulfate de cuivre (CuSO4·5H2O) et d'alun (KAl (SO4) 2·12H2O). Au XIIIe siècle, Albert le Grand l'utilise pour séparer l'or et l'argent.
Au milieu du XVIIe siècle, Johann Rudolf Glauber obtient l'acide nitrique par distillation du salpêtre en présence d'acide sulfurique, procédé utilisé en laboratoire jusqu'au XXIe siècle. Au cours du XVIIIe siècle, Antoine Lavoisier montre que l'acide nitrique contient à la fois de l'oxygène et de l'azote, la composition précise étant déterminée plus tard par Henry Cavendish.
La fabrication industrielle d'acide nitrique ne prend son essor qu'au cours du XIXe siècle, le salpêtre et l'acide sulfurique étant alors bon marché et disponibles en grandes quantités. En 1838, Frédéric Kuhlmann découvre qu'il est envisageable de l'obtenir par oxydation de l'ammoniac en présence de platine. Cependant, l'ammoniac indispensable demeure d'un coût énormément trop élevé jusqu'à l'invention du procédé Haber par Fritz Haber en 1909 et de son industrialisation sous la supervision de Carl Bosch de 1909 à 1913 (procédé Haber-Bosch). Wilhelm Ostwald met alors au point le procédé Ostwald qui sert à fabriquer de l'acide nitrique par oxydation de l'ammoniac, procédé qui demeure le plus utilisé au XXIe siècle.
Propriétés physico-chimiques
L'acide nitrique pur est un liquide incolore et inodore ; diverses impuretés le colorent fréquemment en jaune brun. À température ambiante, il libère des fumées rouges ou jaunes, du fait de sa décomposition partielle en dioxyde d'azote sous l'effet de la lumière.
L'acide nitrique est un agent oxydant puissant; ses réactions avec des composés comme les cyanures, carbures, et poudres métalliques peuvent être explosives.
Les réactions de l'acide nitrique avec énormément de composés organiques, comme la térébenthine, sont violentes, le mélange étant hypergolique (c'est-à-dire auto-inflammable).
C'est un acide fort de pKa = -1, 37 : en solution aqueuse, il se dissocie totalement en un ion nitrate NO3- et un proton hydraté. Les sels de l'acide nitrique (qui contiennent l'ion nitrate) sont nommés des nitrates. La quasi totalité d'entre eux sont particulièrement solubles dans l'eau.
L'acide nitrique et ses sels, les nitrates, ne doivent pas être confondus avec l'acide nitreux et ses sels, les nitrites.
| Gew % HNO3 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Masse volumique (g/cm³) |
1, 00 | 1, 05 | 1, 12 | 1, 18 | 1, 25 | 1, 31 | 1, 37 | 1, 42 | 1, 46 | 1, 48 | 1, 513 |
| Viscosité (mPa·s) |
1, 00 | 1, 04 | 1, 14 | 1, 32 | 1, 55 | 1, 82 | 2, 02 | 2, 02 | 1, 84 | 1, 47 | 0, 88 |
| Tfus (°C) | 0 | -7 | -17 | -36 | -30 | -20 | -22 | -41 | -39 | -60 | -42 |
| Teb (°C) | 100, 0 | 101, 2 | 103, 4 | 107, 0 | 112, 0 | 116, 4 | 120, 4 | 121, 6 | 116, 6 | 102, 0 | 86, 0 |
| p (HNO3) (mbar) | 0, 0 | 0, 0 | 0, 0 | 0, 0 | 0, 0 | 0, 3 | 1, 2 | 3, 9 | 14, 0 | 36, 0 | 60, 0 |
| p (H2O) (mbar) | 23, 3 | 22, 6 | 20, 2 | 17, 6 | 14, 4 | 10, 5 | 6, 5 | 3, 5 | 1, 2 | 0, 3 | 0, 0 |
Réactions chimiques comportant l'acide nitrique
Action sur les métaux
L'acide nitrique réagit différemment des autres acides forts (HCl, H2SO4) sur les métaux à cause des propriétés oxydantes du radical NO3. Ainsi, HNO3 réagissant sur un métal ne donne jamais de dégagement de dihydrogène, ce qui est le cas pour la majorité des autres acides réagissant sur un métal. La formule suivante donne l'équation de la réaction globale pour toute réaction chimique entre l'acide nitrique (HNO3) et un métal 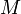 de valence
de valence 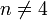 :
:
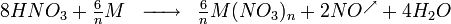 ,
, 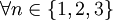 .
.
Les métaux tels que le nickel, le cobalt, le cuivre, le mercure, l'argent, le plomb, le sélénium, le bismuth, le zinc et le cadmium se dissolvent dans l'acide nitrique. D'autres métaux forment un film de passivation, parmi lesquels figurent l'aluminium, le chrome, le titane, le zirconium, le hafnium, le gallium, l'induim, le niobium, le tantale, le thorium et le bore. Les alcalino-terreux se dissolvent dans l'acide dilué, mais passivent dans l'acide concentré. Les alliages à base de fer se dissolvent mieux dans l'acide dilué[11].
Production et synthèse
L'acide nitrique dilué est obtenu en mélangeant du dioxyde d'azote (NO2) avec de l'eau ; les solutions commerciales comprennent le plus souvent entre 52% et 68% d'acide nitrique. Les solutions plus concentrées sont obtenues par distillation. L'acide nitrique formant un azéotrope avec l'eau dans une proportion de 68% d'acide nitrique et 32% d'eau, l'obtention d'acide nitrique particulièrement pur impose de le distiller en présence d'acide sulfurique. Lorsque la solution comprend plus de 86% d'acide nitrique, il est dit «fumant» et existe en deux variétés : blanche et rouge. L'acide nitrique fumant blanc est aussi nommé 100% car presque (moins de 2%) sans eau.
La production commerciale de l'acide nitrique est faite par le procédé Ostwald et se réalise en 3 étapes à partir de l'ammoniac :
En premier, l'ammoniac est oxydé en présence d'un catalyseur comme le platine rhodié, pour former du monoxyde d'azote (NO) (étape fortement exothermique) :
Puis le monoxyde d'azote est oxydé par l'oxygène (O2) et produit du dioxyde d'azote (NO2) :
Enfin, le dioxyde d'azote est dissout dans l'eau selon la réaction :
pour produire l'acide nitrique dilué.
Le monoxyde d'azote produit est recyclé, et l'acide nitrique concentré par distillation jusqu'à un maximum de 68% (azéotrope du mélange acide nitrique - eau). Les concentrations plus élevées sont atteintes par traitement au nitrate de magnésium (Mg (NO3) 2). Globalement, ce procédé permet d'atteindre un rendement de 96%.
L'acide nitrique peut aussi être obtenu en faisant réagir du nitrate de potassium (KNO3) et de l'acide sulfurique concentré (H2SO4), puis en distillant le mélange à 83 °C jusqu'à ce qu'il ne reste plus dans le milieu qu'un solide blanc cristallisé composé de KHSO4. L'acide nitrique obtenu est de acide nitrique fumant rouge. L'acide nitrique fumant blanc peut être obtenu en éliminant les oxydes d'azote dissous en réduisant la pression à 1/3 d'atmosphère à peu près durant 10-30 minutes. (L'acide nitrique fumant rouge contient une quantité non négligeable d'oxydes d'azote, d'où sa couleur rouge, alors que l'acide nitrique fumant blanc ne peut contenir qu'un maximum de 0, 5% de NO2).
La production mondiale annuelle d'acide nitrique est de l'ordre de 60 millions de tonnes.
Utilisations
Utilisé couramment comme un réactif de laboratoire, surtout pour des réactions de nitration de composés organiques, il est utilisé pour fabriquer par synthèse chimique des engrais comme le nitrate d'ammonium. 75% de la production d'acide nitrique est utilisée dans la fabrication d'engrais azotés.
Comme il réagit avec la majorité des métaux (sauf l'or, l'iridium et le platine), il est particulièrement utilisé en métallurgie et en microélectronique. Mélangé avec l'acide chlorhydrique, il forme l'eau régale, l'un des rares réactifs capable de dissoudre l'or et le platine.
Il a été l'un des premiers comburants des mélanges de propergols pour les moteurs-fusée, associé au kérosène, à l'1, 1-diméthylhydrazine-UDMH -Diméthylhydrazine asymétrique ( (CH3) 2N-NH2) - et au MMH -monométhylhydrazine (CH3-NH-NH2) - comme carburant. Dans cette utilisation, le caractère particulièrement corrosif de l'acide nitrique a été longtemps un problème, résolu par l'addition de 0, 6% d'acide fluorhydrique qui assure une passivation du métal. Il est remplacé depuis le début des années 1990 par le tétraoxyde d'azote (N2O4). Il est aussi utilisé pour des décapants industriels, à petite dose. On obtient de la nitroglycérine en le mélangeant avec de la glycérine.
Il a été utilisé au XIXe siècle pour la conservation de la viande.
Sécurité
L'acide nitrique est un acide fort, qui peut provoquer de graves brûlures. L'inhalation des vapeurs peut entraîner un œdème pulmonaire. Au contact d'acide nitrique concentré, la peau humaine se teint en jaune du fait de réactions avec la kératine. C'est un composé modérément toxique avec une dose létale de 430 mg·kg-1. C'est aussi un oxydant puissant qui réagit vivement avec les réducteurs et les matières combustibles pouvant occasionner des explosions.
Notes et références
- ACIDE NITRIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd. , 2736 p. (ISBN 142006679X et 978-1420066791) , p. 9-50
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd. , Relié, 2804 p. (ISBN 978-1-420-09084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd. , 2736 p. (ISBN 9781420066791) , p. 10-205
- Office of Radiation, Chemical & Biological Safety (ORCBS) . Consulté le 16 avril 2009
- Entrée de «Nitric acid solution» dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 12 novembre 2009 (JavaScript indispensable)
- «Acide nitrique» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Nitric acid sur hazmap. nlm. nih. gov. Consulté le 14 novembre 2009
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, 1996, 251 p. (ISBN 0803120664) [lire en ligne], p. 75
- (en) Cet article est partiellement ou en totalité issu de l'article de Wikipédia en anglais intitulé «Nitric acid» (voir la liste des auteurs)
- (de) Cet article est partiellement ou en totalité issu de l'article de Wikipédia en allemand intitulé «Salpetersäure» (voir la liste des auteurs)
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



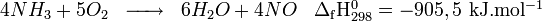
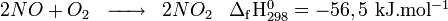

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité